医疗器械唯一标识(UDI)规则解读
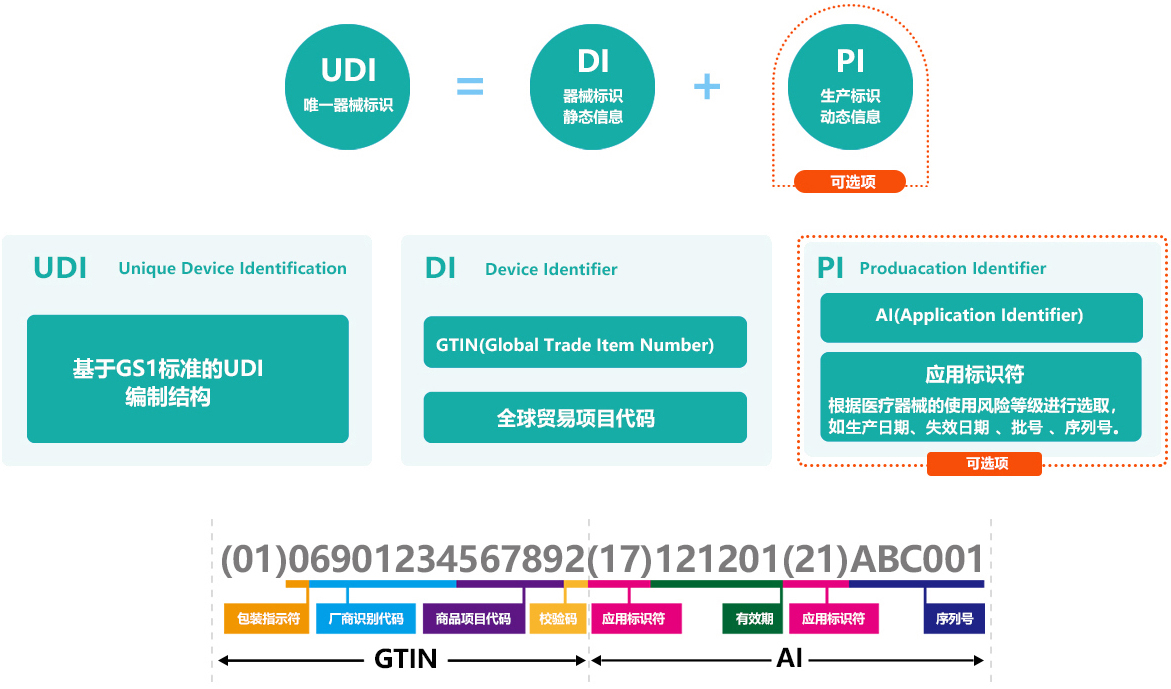
医疗器械唯一标识(UDI)是国际通用的商品标识系统中的一个重要概念,它是指在医疗器械产品或者包装上附载的,由数字、字母或者符号组成的代码,用于对医疗器械进行唯一性识别1。UDI可以被看作医疗器械产品在供应链中的唯一“身份证”,应包括产品标识和生产标识。
1. UDI的组成
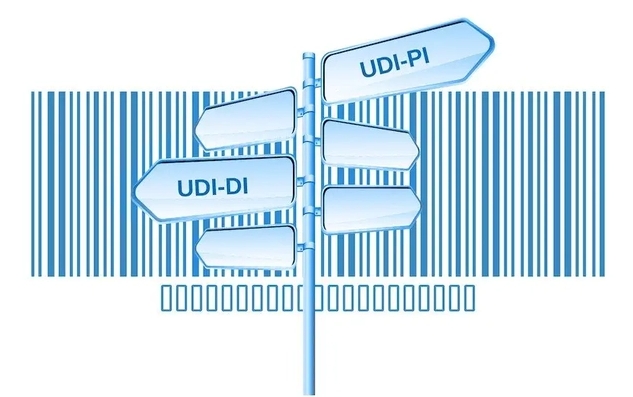
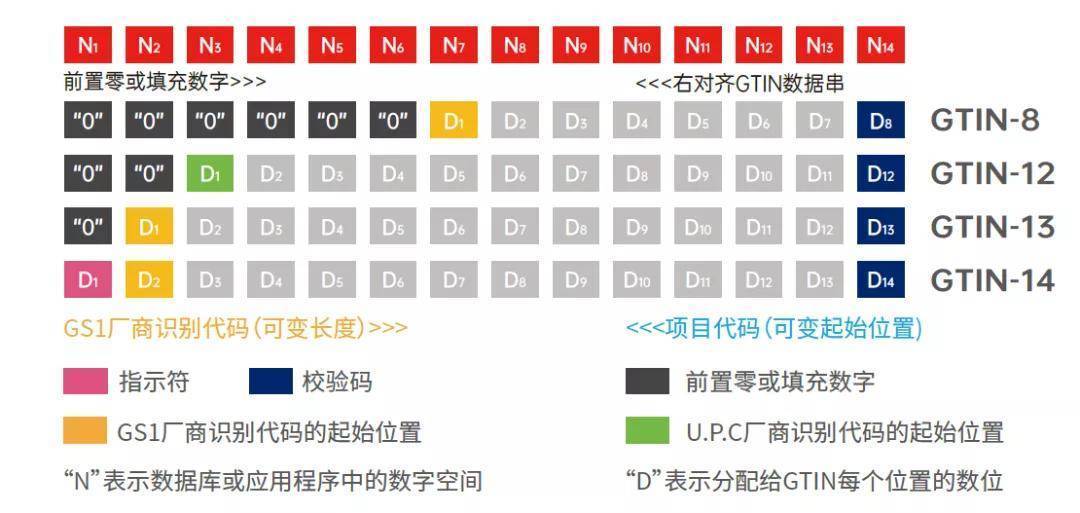
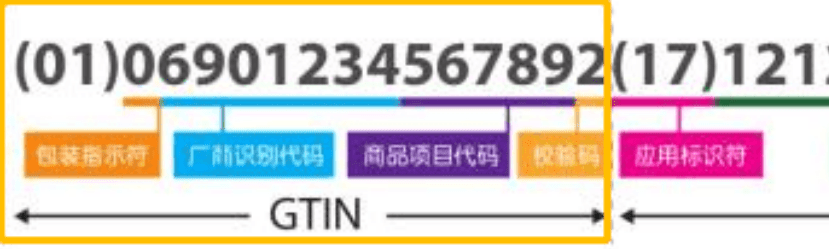
UDI的组成包括产品标识(DI)和生产标识(PI)。产品标识用于识别注册人/备案人、医疗器械型号规格和包装的唯一代码。生产标识则由医疗器械生产过程相关信息的代码组成,根据监管和实际应用需求,可包含医疗器械序列号、生产批号、生产日期、失效日期等。
2. UDI的实施
UDI的实施是中国药品监督管理局为了加强医疗器械全生命周期管理,保障公众用械安全而推出的一项重要政策。实施UDI需要经过一系列的步骤,包括选择发码机构、产品赋码、标签打印和标识申报等2。中国的发码机构主要有中国物品编码中心、中关村工信二维码技术研究院和阿里健康科技(中国)有限公司。
3. UDI的标签生成
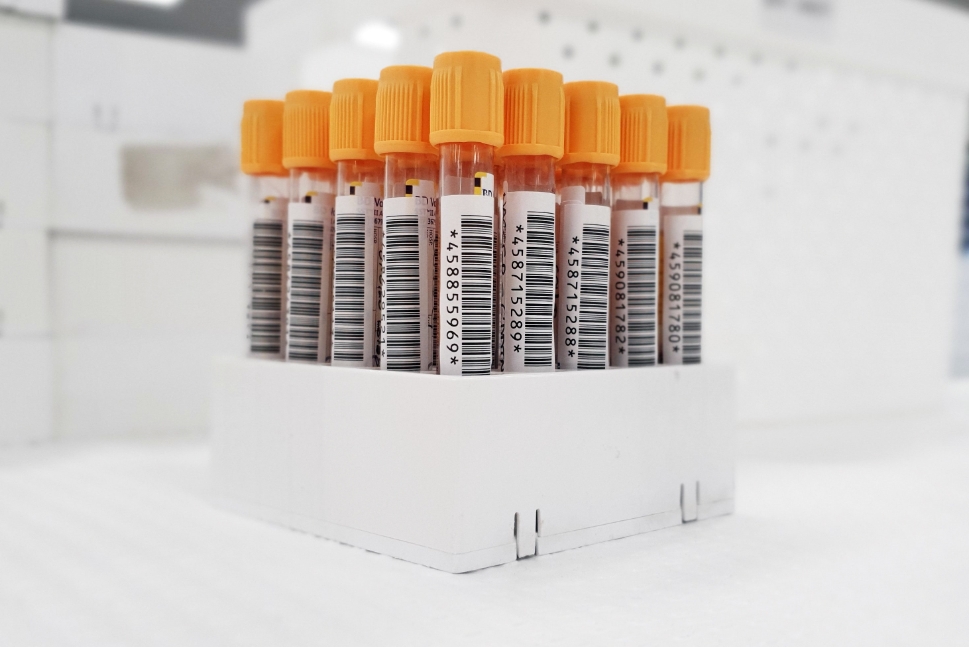
在产品完成GTIN(UDI-DI)分配,并确定了产品的生产标识 UDI-PI后,下一步就是生成UDI标签。按照中国法规的要求,UDI应包括两个部分:机器可读码和人工可读码。目前最为常见的形式就是一维码和(或)二维码。
4. UDI的数据管理
医疗器械唯一标识数据库是指储存医疗器械唯一标识的产品标识与关联信息的数据库。注册人/备案人应当在申请医疗器械注册、注册变更或者办理备案时,在注册/备案管理系统中提交其产品标识。此外,注册人/备案人还需要负责按照相关标准或者规范要求上传、维护和更新唯一标识数据库中的相关数据,对数据的真实性、准确性、完整性负责。
5. UDI的发码机构
发码机构是指负责分配和管理医疗器械唯一标识的机构。在中国,认可的发码机构有三家:中国物品编码中心、中关村工信二维码技术研究院和阿里健康科技(中国)有限公司。这些机构需要具备完善的管理制度和运行体系,确保按照其标准创建的医疗器械唯一标识的唯一性,并符合我国数据安全有关要求。
6. UDI的重要性
UDI的建立使得医疗器械数字化信息链追溯成为可能,从而实现医疗器械上市后不良事件报告、产品召回、追踪追溯等。这对于严守医疗器械安全底线、助力医疗器械产业高质量发展都将起到积极作用。
综上所述,医疗器械唯一标识(UDI)是一项重要的政策,它对于保障医疗器械的安全性和有效性具有重要意义。医疗器械生产企业需要按照相关规定实施UDI,以满足监管要求和市场需求。
 UDI网-UDI申请编码赋码软件专业知识网
UDI网-UDI申请编码赋码软件专业知识网