UDI码的要求
UDI码的要求主要包括两个部分:器械识别码和生产识别码。器械识别码主要是关于医疗器械的专利以及型号或者是贴标者相关内容方面的信息。而生产识别码所包含的具体的信息相对就比较多了,涉及到了产品的生产批次,之前的识别号以及FDA产品代码和单个器械的数量等多个内容。但并不是所有的类别都需要使用第二项生产识别码,所以大家着重关注器械识别码就可以了。
UDI码的编码规则
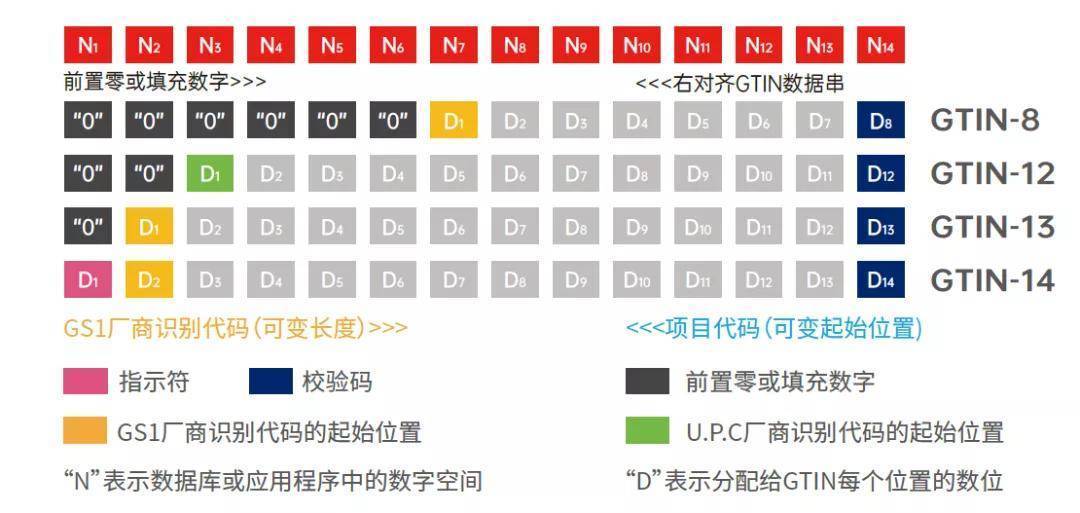
UDI码的编码规则一般情况下包括厂商识别代码,商品项目代码和校验码三部分。厂商识别代码一般情况下是会有7~10位数字,一般情况下是根据物品编码中心进行分配以及管理的,国内这一部分当中的前缀码是690~695。而校验码其实是非常的重要的,能够有效的校验整个编码的正误,但他其实是非常的简单的,一般情况下只有一位数字,所以UDI编码编码规则其实还是比较简单的。
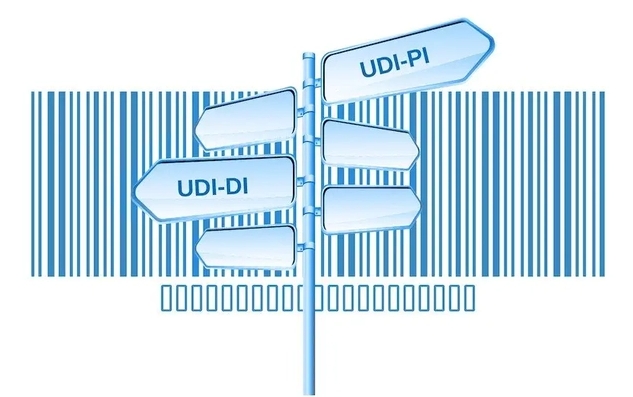
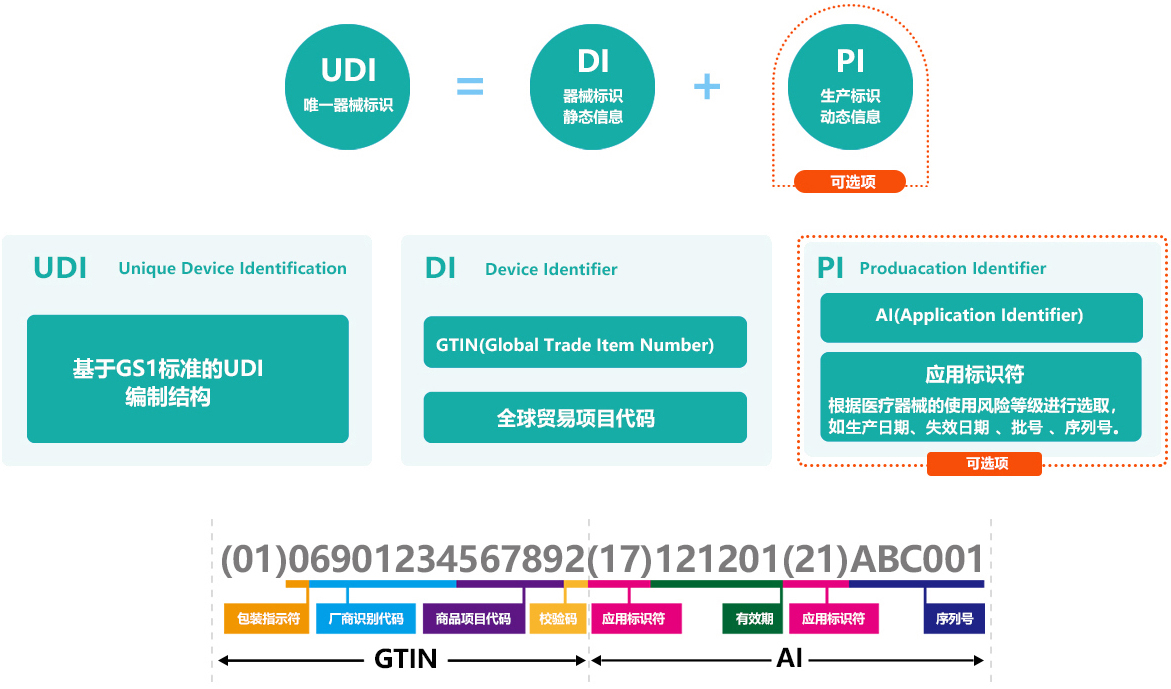
此外,UDI码是由产品标识(DI)和生产标识(PI)组成,产品标识(DI)是识别注册人/备案人、医疗器械型号规格和包装的唯一代码,是从数据库获取医疗器械相关信息的“关键字”,是唯一标识的必需部分;生产标识(PI)包括与生产过程相关的信息,包括产品批号、序列号、生产日期和失效日期等,可与产品标识联合使用,满足医疗器械流通和使用环节精细化识别和记录的需求。
基于GS1标准的UDI编制结构,包括器械标识静态信息DI、生产标识动态信息PI。其中,DI包括全球贸易项目代码GTIN,具体有包装指示符、厂商识别代码、商品项目代码、校验码等。PI具体包括应用标识符、有效期、序列号、生产日期等。由于医疗器械使用风险和监管追溯要求的不同,其器械的唯一标识也会随之变化。UDI可由DI单独表示,也可由DI加PI联合使用表示。根据不同的医疗器械产品,可标识到规格型号、批次、单品。
UDI由静态DI码和动态PI码构成,国家药品监督管理局国家药品监督管理局医疗器械唯一标识数据库 (nmpa.gov.cn)中存储的是DI码且不包含PI码。由于PI码跟生产批次有关属于动态属性,可通过规则进行动态解析来使用,也是本文要研究的内容;而DI由“发码机构”统一编码,后续不可随意变更且与生产批次无关,可直接匹配DI库查询即可。
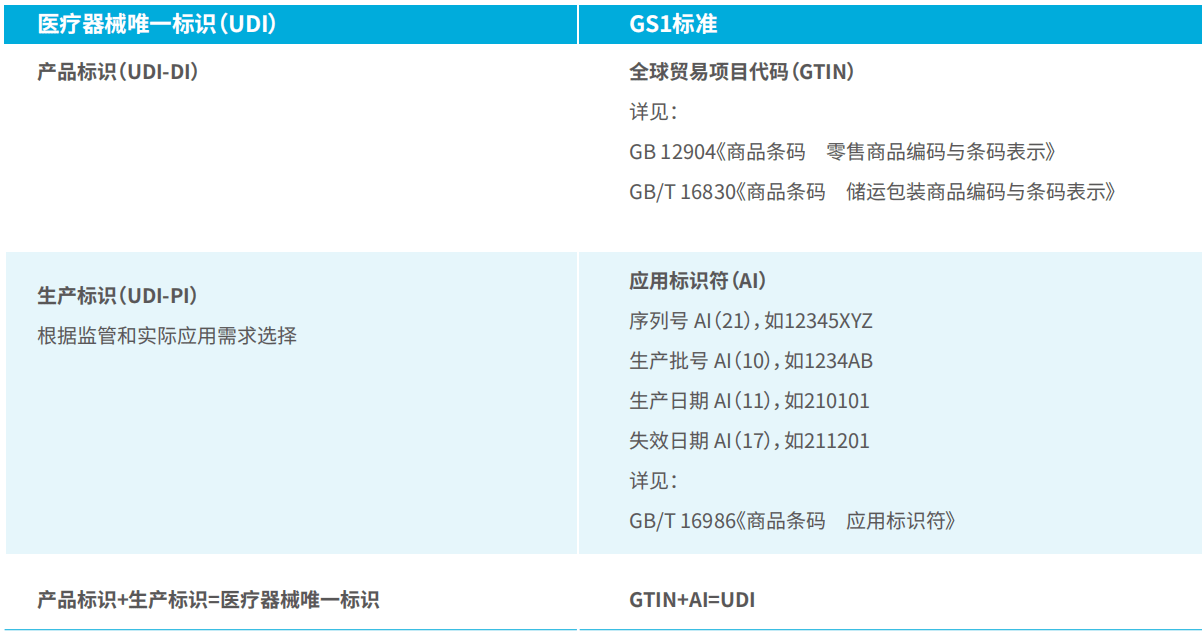
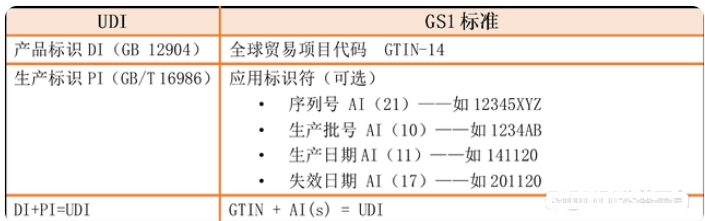
医疗器械唯一标识包括产品标识和生产标识, 即UDI=产品标识(DI)+生产标识(PI)。
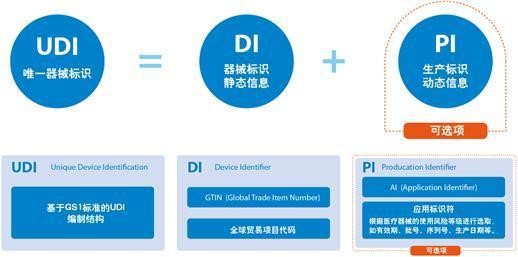
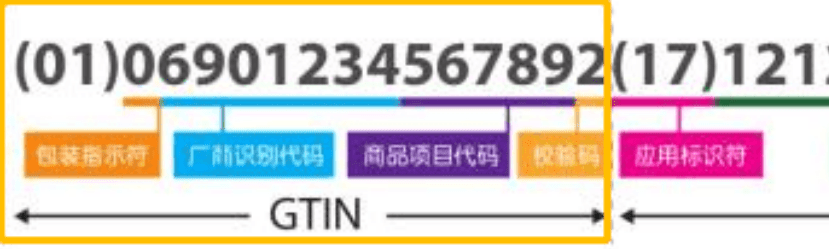
在GS1编码体系中,产品标识为识别注册人/备案人、医疗器械型号规格和包装的唯一代码。GS1标准的产品标识可使用全球项目代码(GTIN)表示。
生产标识由医疗器械生产过程相关信息的代码组成,根据监管和实际应用需求,可包含医疗器械序列号、生产批号、生产日期、失效日期等。GS1标准的生产标识可使用应用标识符(AI)表示。其对应关系如下:
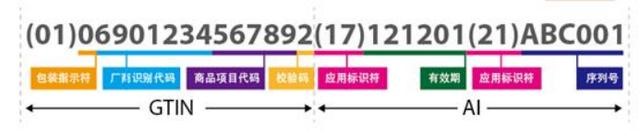
条码中的每个数据元素前面都有其对应的 AI。应用标识符及其对应的数据编码共同完成特定信息的标识。例如,GTIN 的 AI 是(01)。因此,当“01”首先出现在扫描的数字字符串中时,意味着其后面紧接着的是一个 GTIN。当以人工识读的形式呈现时,AI 通常显示在括号中。但是,括号并不是条码编码数据的一部分。更多信息请参考《商品条码应用标识符》(GB/T 16986-2018)。

 UDI网-UDI申请编码赋码软件专业知识网
UDI网-UDI申请编码赋码软件专业知识网